В совокупности результаты исследования, опубликованные в текущем выпуске журнала PLoS Genetics, показывают, что объединяющий клеточный и биохимический механизм лежит в основе этиологии и патогенеза TCS и его возможной профилактики, независимо от мутации гена, являющейся причиной этого заболевания.
Мутации потери функции в трех генах человека, TCOF1, POLR1C и POLR1D, были вовлечены в TCS и, как полагают, являются причиной около 90 процентов диагнозов этого врожденного черепно-лицевого состояния.
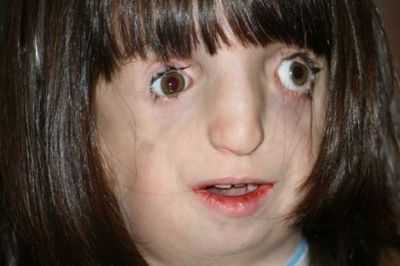
Клинические проявления TCS включают лицевые аномалии, такие как маленькая челюсть и расщелина неба, потеря слуха и респираторные проблемы. Пациенты с TCS обычно переносят несколько операций, но редко они полностью корректируют. Обнаружив механизм действия, общий для всех трех генов, ученые Стоуэрса продвинули научное понимание этиологии и патогенеза TCS и определили возможные новые пути предотвращения или лечения врожденного дефекта. Это последнее исследование лаборатории исследователя Стоуэрса Пола Трейнора, доктора философии.D., основное внимание уделялось Polr1c и Polr1d, роль которых в качестве генетической причины TCS была выявлена в исследовании 2011 года небольшой группы пациентов, у которых был диагностирован TCS, но у которых не было мутации TCOF1.
В отличие от POLR1C и POLR1D, TCOF1 давно признан причинным геном в TCS и, как результат, был более тщательно исследован.
«До того, как мы начали исследование, ничего не было известно о роли Polr1c и Polr1d в черепно-лицевом развитии», — сказала Кристин Ватт, доктор философии.D., ведущий автор статьи PLoS Genetics и научный сотрудник лаборатории Trainor. «Используя рыбок данио в качестве модели на животных, мы решили изучить функциональную роль polr1c и polr1d во время эмбриогенеза и, в частности, в черепно-лицевом развитии."
Трейнор, Ватт и их сотрудники сравнили результаты своих исследований polr1c и polr1d с результатами предыдущих исследований Tcof1, проведенных ими и другими лабораториями.
Во всех трех моделях потери функции исследователи обнаружили, что цепь клеточных событий, которая привела к фенотипу TCS аномального черепно-лицевого развития, возникла в рибосомах, клеточных компонентах, которые переводят информационную РНК в белки. Как и ген Tcof1, мутации polr1c и polr1d, как было обнаружено, нарушают биогенез рибосом или производство рибосом, что влияет на образование и выживание клеток-предшественников нервного гребня, предшественников черепно-лицевой кости, хряща и соединительной ткани.
На животных моделях всех трех причинных генов ученые определили, что недостаточный биогенез рибосом запускает зависимый от р53 механизм гибели клеток в клетках-предшественниках нервного гребня. В результате активации гена p53 развивающиеся эмбрионы больше не производят столько клеток нервного гребня, сколько необходимо для правильного формирования черепно-лицевого скелета.
Однако в моделях polr1c и polr1d, как и в моделях Tcof1, ученые Стоуэрса обнаружили, что, экспериментально блокируя активацию p53, они могут восстановить популяцию клеток нервного гребня и тем самым спасти краниоскелетный хрящ на моделях животных.
Несмотря на эффект спасения, Трейнор сказал, что он не рассматривает «хранителя генома», как часто называют ген p53 из-за его способности подавлять рак, как основу потенциальной терапии для предотвращения или снижения TCS во время эмбрионального развития. По его словам, связь гена p53 с раком делает ингибирование его функции слишком рискованным.
Менее рискованной и, возможно, более эффективной мишенью для профилактики или лечения TCS могло бы быть усиление рибосом, сказал Трейнор, потому что мутации потери функции во всех трех причинных генах включают транскрипцию рибосомной РНК (рРНК). Polr1c и Polr1d, например, являются субъединицами РНК-полимераз I и III, которые необходимы для биогенеза рибосом.
«Вместо того, чтобы блокировать p53, лучшим подходом может быть попытка предотвратить TCS путем лечения проблемы в биогенезе рибосом, которая запускает активацию p53 и потерю клеток нервного гребня», — сказал Трейнор.
В своем исследовании эмбрионов рыбок данио Трейнор и его сотрудники также определили, что polr1c и polr1d пространственно-временны и динамически экспрессируются, особенно во время черепно-лицевого развития. Кроме того, у эмбрионов рыбок данио с мутациями потери функции polr1c и polr1d развиваются аномалии в развитии краниофациального хряща, имитирующие клинические проявления TCS у пациентов.
Трейнор сказал, что он и его коллеги-исследователи были удивлены тем, что мутации в polr1c и polr1d, а также Tcof1 специфически влияют на черепно-лицевое развитие, потому что биогенез рибосом происходит в каждой клетке тела. Ожидается, что мутация гена, который является частью рибосомного комплекса, будет пагубной для каждой из этих клеток, сказал он.
Однако в моделях рыбок данио мутация, по-видимому, в первую очередь влияет на клетки нервного гребня-предшественника. Трейнор сказал, что он и его команда предполагают, что клетки-предшественники нервного гребня могут быть особенно чувствительны к нарушениям в биогенезе рибосом во время эмбриогенеза.
Таким образом, в результате исследования были выявлены новые животные модели для TCS: рыбки данио с мутациями потери функции polr1c и polr1d. Более того, наличие общего механизма действия может упростить исследование, особенно поиск терапии для предотвращения или лечения TCS.
По словам Трейнора, исследовавшего молекулярное происхождение и развитие, из-за сходства трех причинных генов, «мы сможем разработать творческие способы предотвращения ТКС, которые окажутся эффективными у лиц из группы риска, у которых есть одна из генных мутаций». ТКС и связанных черепно-лицевых нарушений развития в течение 10 лет.
Среди других авторов этой статьи — Аннита Ахиллеос, доктор философии.D., из Института Стоуэрса и Синтии Л. Небен, к.D., и Эми Э. Меррилл, доктор философии.D., из Университета Южной Калифорнии.
Исследования финансировались Институтом Стоуэрса, Национальным институтом стоматологических и черепно-лицевых исследований Национальных институтов здравоохранения (NIH R01DE016082, DE025222), Национальным институтом детского здоровья и развития человека NIH (HD060549), Американской ассоциацией врачей. Анатомы и Марш десятицентовиков (# 6-FY15-233).
Авторы полностью несут ответственность за содержание и не обязательно отражают официальную точку зрения NIH.
Резюме выводов
Были идентифицированы три различные генетические мутации, вызывающие синдром Тричера Коллинза (TCS), редкое врожденное нарушение черепно-лицевого развития, которым страдает примерно 1 из 50 000 живорождений. Помимо лицевых деформаций, дети, страдающие СКС, часто страдают потерей слуха, проблемами со зрением и респираторными проблемами из-за пороков развития дыхательных путей.
Этим детям обычно делают несколько операций, но они редко проходят полностью.
Благодаря фундаментальным исследованиям с использованием лабораторных моделей животных, таких как рыбки данио и мыши, ученые из Института медицинских исследований Стоуэрса надеются лучше понять, как TCS начинается на самом базовом уровне, клетке, и как этот врожденный дефект можно безопасно и эффективно предотвратить или свести к минимуму. в будущем.
В этом последнем исследовании исследователи Стоуэрса исследовали аналоги двух генов человека, POLR1C и POLR1D, которые были идентифицированы как вызывающие TCS в исследовании 2011 года небольшой группы пациентов, у которых был диагностирован TCS, но у которых не было самого распространенного гена. мутация в TCS. Этот ген, TCOF1, был обнаружен в связи с TCS около 20 лет назад.
Ученые Стоуэрса обнаружили, что мутации в polr1c и polr1d, такие как Tcof1, разрушают одну и ту же группу клеток — клетки нервного гребня, которые образуют черепно-лицевой скелет. Надеемся, что их общие черты помогут ускорить темпы будущих исследований TCS.
