В отчете, опубликованном в Nature, исследователи из Исследовательской сети Атласа генома рака заявили, что они проанализировали 295 образцов рака желудка (желудка), ища способы разделить их на группы со схожими ключевыми дефектами ДНК и молекулярными аберрациями. По их словам, чрезвычайно важно определить категории, которые могут быть полезны при выборе терапии для пациентов.
«Мы четко сошлись на четырех группах рака желудка с различными особенностями и классами молекулярных изменений», — сказал Адам Басс, доктор медицины, автор сообщения. Он является директором трансляционных исследований Центра рака пищевода и желудка в Дана-Фарбер и ассоциированным членом Института Броуда Массачусетского технологического института и Гарварда.
По словам Басса, группирование раковых заболеваний таким образом поможет исследователям включать пациентов в клинические испытания, в которых тестируются лекарства, предназначенные для лечения их конкретного подтипа рака желудка. По его словам, существует острая необходимость в новых методах лечения, потому что «это агрессивный рак, и пятилетняя выживаемость составляет от 20 до 25 процентов."
Аденокарциномы желудка — подавляющее большинство случаев рака желудка — вызывают более 700 000 смертей во всем мире ежегодно. По оценкам Американского онкологического общества, в 2014 году в США будет диагностировано 22 220 случаев заболевания, из которых около 10 990 смертей.
Рак желудка — это в основном заболевание пожилых людей. Инфекция бактерией Helicobacter pylori (H. pylori) является основной причиной.
Другие факторы риска включают диету, курение, географическое положение и этническую принадлежность, а также некоторые наследственные синдромы рака.
Исследования биологии рака желудка и разработка новых методов лечения были трудными из-за его разнообразия и наличия различных патологических форм. «Это очень разнородное заболевание, но в большинстве клинических испытаний использовался универсальный подход и предпринимались попытки найти единую оптимальную терапию для лечения рака желудка», — сказал Басс. "Этот традиционный подход, вероятно, способствовал медленному прогрессу, которого мы достигли в лечении этого рака."
Новое исследование является частью проекта Атлас генома рака (TCGA), финансируемой из федерального бюджета инициативы, в которой участвуют большие международные группы исследователей и центры, которые каталогизируют геномные характеристики по спектру различных форм рака с целью создания новой основы для изучения понимание этих видов рака, что позволяет улучшить диагностику, лечение и профилактику.
Группа исследователей рака желудка собрала свежие, замороженные образцы тканей и образцы крови у 295 пациентов из больниц по всему миру, которые не получали химиотерапию или лучевую терапию.
Образцы тканей были проанализированы с помощью шести различных технологий молекулярного анализа. Среди них: секвенирование ДНК, кодирующей белок в каждой опухоли; обнаружение мутаций или отсутствующих или дополнительных копий генных последовательностей; определение статуса метилирования ДНК (химические изменения, влияющие на активность генов); секвенирование информационной РНК и микроРНК в опухолях и оценка экспрессии ключевых белков.
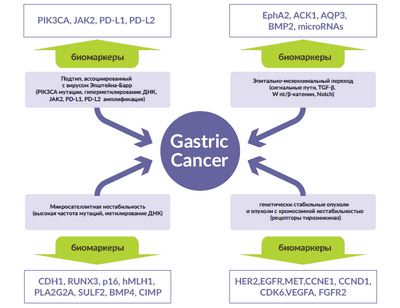
Когда вычислительные методы были применены к большому количеству результирующих данных, рак подразделялся на четыре подтипа:
Опухоли, содержащие вирус Эпштейна-Барра (EBV), а также мутации в пути гена PIK3CA, крайнее гиперметилирование ДНК и дополнительные копии генов PD-L1 и PD-L2.
Эта группа составляла около 10 процентов раковых заболеваний. Басс сказал, что эти результаты предполагают, что ингибиторы пути PI3-K могут иметь большое значение при этих раковых заболеваниях. Кроме того, по его словам, данные о повышенных уровнях PD-L1 и PD-L2, ключевых регуляторов иммунного ответа, позволяют предположить, что новые иммунотерапевтические агенты будут протестированы на этих пациентах.
Опухоли, в которых неисправные механизмы репарации ДНК вызывают высокий уровень мутаций, многие из которых приводят к потенциальной активации сигнальных белков, связанных с раком, на которые можно воздействовать новыми точными лекарствами. Около 20 процентов опухолей попали в этот подтип.
Самая большая категория опухолей, составляющая около половины образцов рака, была названа «хромосомно нестабильной»."Эти раковые клетки содержат множество лишних или отсутствующих частей генов и хромосом. Басс сказал, что эти опухоли «имеют поразительное количество геномных амплификаций [дополнительных копий] ключевых генов, способствующих развитию рака», для которых существуют или разрабатываются таргетные методы лечения.
Этот подтип опухоли часто встречается на стыке желудка и пищевода — тип рака желудка, который резко увеличивается в Соединенных Штатах, сказал он.
Четвертая группа опухолей была названа «геномно стабильной», поскольку им не хватало молекулярных характеристик трех других типов. Эти опухоли, составляющие 20 процентов образцов, были в основном опухолями особого класса рака желудка, называемого опухолями диффузного типа.
«Эти опухоли особенно опасны из-за их способности быстро метастазировать, а также из-за отсутствия эффективных методов лечения», — сказал Басс. Команда определила новый набор геномных изменений в пути, называемом сигнальным путем RHOA, примерно в 30 процентах этих опухолей. «Этот результат открывает совершенно новое направление исследований, которое позволит нам изучить, что лежит в основе этой смертельной формы рака желудка, и в конечном итоге разработать новые методы лечения», — сказал Басс.
