Обработанные клетки ведут себя так, как если бы они были намного моложе необработанных клеток, беспорядочно размножаясь в лабораторной посуде, а не застаиваясь или умирая.
По словам ученых, процедура, которая включает использование модифицированного типа РНК, улучшит способность исследователей генерировать большое количество клеток для изучения или разработки лекарств. Клетки кожи с теломерами, удлиненными в результате процедуры, смогли делиться в 40 раз больше, чем необработанные клетки. Исследование может указать на новые способы лечения заболеваний, вызванных укороченными теломерами.
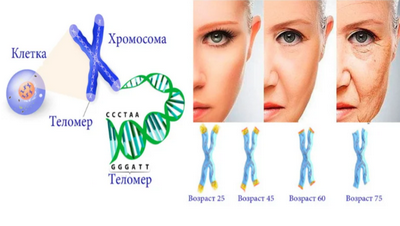
Теломеры — это защитные колпачки на концах нитей ДНК, называемых хромосомами, в которых находятся наши геномы. У молодых людей длина теломер составляет от 8000 до 10000 нуклеотидов.
Однако они укорачиваются с каждым делением клетки, и когда они достигают критической длины, клетка перестает делиться или умирает. Эти внутренние «часы» затрудняют рост большинства клеток в лаборатории более чем на несколько удвоений клеток.
‘Возвращение внутренних часов назад’
«Теперь мы нашли способ удлинить человеческие теломеры на 1000 нуклеотидов, повернув внутренние часы в этих клетках вспять на время, эквивалентное многим годам человеческой жизни», — сказала Хелен Блау, доктор философии, профессор микробиологии и иммунологии в Стэнфорде. и директор университетской лаборатории биологии стволовых клеток Бакстера. "Это значительно увеличивает количество клеток, доступных для таких исследований, как тестирование на наркотики или моделирование болезней."
Статья с описанием исследования была опубликована сегодня в журнале FASEB Journal.
Блау, которому также принадлежит награда Дональда Э. и Делия Б. Профессор Бакстера, старший автор. Постдокторант Джон Рамунас, доктор философии из Стэнфорда, разделяет ведущее авторство с Эдуардом Якубовым, доктором философии, из Хьюстонского научно-исследовательского института методистов.
Исследователи использовали модифицированную информационную РНК для удлинения теломер. РНК передает инструкции от генов в ДНК фабрикам по производству белка в клетке.
РНК, использованная в этом эксперименте, содержала кодирующую последовательность для TERT, активного компонента природного фермента, называемого теломеразой. Теломераза экспрессируется стволовыми клетками, в том числе теми, которые дают начало сперматозоидам и яйцеклеткам, чтобы теломеры этих клеток оставались в идеальной форме для следующего поколения.
Однако большинство других типов клеток экспрессируют очень низкие уровни теломеразы.
Переходный эффект — преимущество
Недавно разработанный метод имеет важное преимущество перед другими потенциальными методами: он временный. Модифицированная РНК предназначена для снижения иммунного ответа клетки на лечение и позволяет сообщению, кодирующему TERT, оставаться немного дольше, чем не модифицированное сообщение. Но он рассеивается и исчезает примерно через 48 часов.
По истечении этого времени вновь удлиненные теломеры начинают постепенно укорачиваться снова с каждым делением клетки.
Переходный эффект чем-то похож на нажатие педали газа в одной из машин, медленно движущихся по инерции до остановки. Автомобиль с дополнительным всплеском энергии будет двигаться дальше, чем его аналоги, но он все равно остановится, когда его импульс вперед будет потрачен.
На биологическом уровне это означает, что обработанные клетки не продолжают делиться бесконечно долго, что сделало бы их слишком опасными для использования в качестве потенциальной терапии у людей из-за риска рака.
Исследователи обнаружили, что всего три применения модифицированной РНК в течение нескольких дней могут значительно увеличить длину теломер в культивируемых клетках мышц и кожи человека. Добавление 1000 нуклеотидов означает увеличение длины теломер более чем на 10 процентов.
Эти клетки делились в чашке для культивирования во много раз больше, чем необработанные клетки: примерно в 28 раз больше для клеток кожи и примерно в три раза больше для мышечных клеток.
«Мы были удивлены и довольны тем, что модифицированная мРНК TERT сработала, потому что TERT строго регулируется и должен связываться с другим компонентом теломеразы», - сказал Рамунас. "Предыдущие попытки доставить мРНК-кодирующий TERT вызвали иммунный ответ против теломеразы, который мог быть вредным.
Напротив, наша методика неиммуногенная. Существующие временные методы удлинения теломер действуют медленно, тогда как наш метод действует всего за несколько дней, чтобы обратить вспять укорочение теломер, которое происходит в течение более чем десятилетия нормального старения. Это говорит о том, что лечение по нашему методу может быть коротким и нечастым."
Возможное использование для терапии
«Этот новый подход прокладывает путь к предотвращению или лечению болезней старения», — сказал Блау. "Есть также крайне изнурительные генетические заболевания, связанные с укорочением теломер, которые могут выиграть от такого потенциального лечения."
Блау и ее коллеги заинтересовались теломерами, когда предыдущая работа в ее лаборатории показала, что мышечные стволовые клетки мальчиков с мышечной дистрофией Дюшенна имеют теломеры, которые были намного короче, чем у мальчиков без этого заболевания. Это открытие не только имеет значение для понимания того, как клетки функционируют — или не функционируют — при создании новых мышц, но также помогает объяснить ограниченную способность выращивать пораженные клетки в лаборатории для изучения.
Исследователи сейчас тестируют свою новую технику на других типах клеток.
«Это исследование является первым шагом к развитию расширения теломер для улучшения клеточной терапии и, возможно, лечения расстройств ускоренного старения у людей», — сказал Джон Кук, доктор медицины, доктор философии.
Кук, соавтор исследования, ранее был профессором сердечно-сосудистой медицины в Стэнфорде. Сейчас он заведует сердечно-сосудистыми науками в Хьюстонском методистском научно-исследовательском институте.
«Мы работаем, чтобы больше узнать о различиях между типами клеток и о том, как мы можем преодолеть эти различия, чтобы сделать этот подход более универсальным», — сказал Блау, который также является членом Стэнфордского института биологии стволовых клеток и Регенеративная медицина.
«Однажды у пациента с мышечной дистрофией Дюшенна можно будет воздействовать на мышечные стволовые клетки, например, чтобы удлинить их теломеры.
Есть также значение для лечения состояний старения, таких как диабет и болезни сердца. Это действительно открыло двери для рассмотрения всех видов потенциального использования этой терапии."
